![]()
タンパク構造化学
構造バイオインフォマティクス
核内受容体リガンド結合領域フォールディングメカニズム、アゴニズム・アンタゴニズムメカニズムに関する理論研究
Motonori Tsuji. Local Motifs Involved in the Canonical Structure of the Ligand-Binding Domain in the Nuclear Receptor Superfamily.J. Struct. Biol.,185, 355-365, 2014.
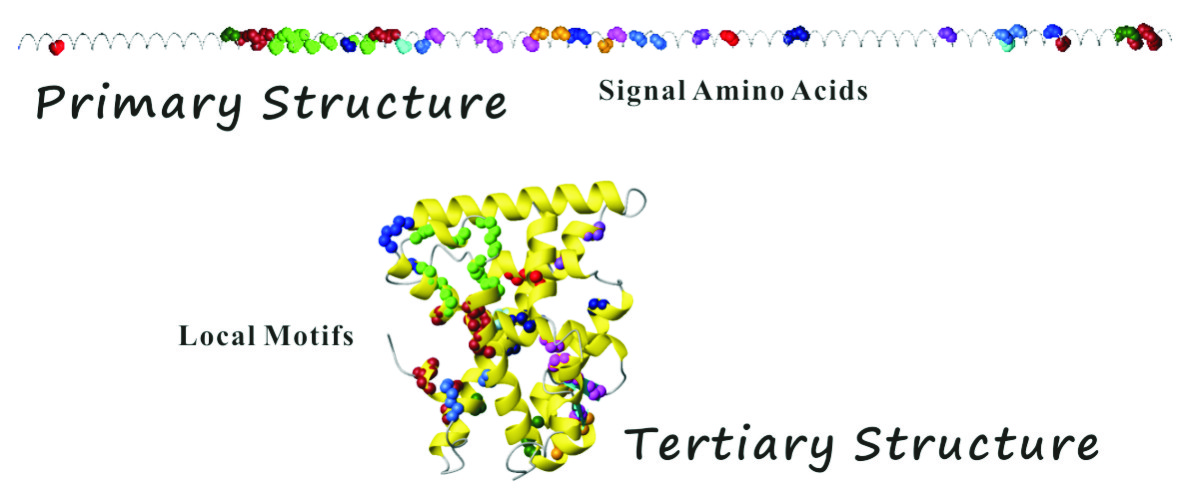
核内受容体スーパーファミリーのリガンド結合領域立体構造が、一次構造で20%以下の相同性でありながらも、例外なく同様のフォールドを採用していること(正準フォールド)に着目し、網羅的なアミノ酸配列および構造アラインメントを実施した。
既知核内受容体リガンド結合領域立体構造を立体電子構造論的視点から網羅的に解析した結果、核内受容体リガンド結合領域の正準フォールドとリガンド結合とに密接に関わる極めて重要な相互作用系が少なくとも11ヶ所存在すること見出した。すなわち、正準フォールドを規定しているへリックス、シート、ランダムコイルの始点と終点(境界構造)には進化的に保存されてきた相同アミノ酸残基(シグナルアミノ酸)が位置しており、一次構造上で遠隔位置にありかつ特定の共通位置にあるこれらシグナルアミノ酸が三次構造上で互いに近接して強い相互作用系(局所モチーフ構造)を形成していることを見出した。これら局所モチーフ構造はレセプター内部では疎水環境下での塩橋などの誘電率に依存する静電相互作用、レセプター表面では疎水性相互作用を採用しており、特に、へリックスの始点・終点では電荷―双極子相互作用が関与し、二次構造のオリエンテーションを制御していることを見出した。すなわち、局所モチーフ構造の会合が正準フォールドの決定因子として寄与しているとする核内受容体リガンド結合領域のフォールディング機構を発見し、これを局所モチーフ理論と名づけた。この発見により、アンフィンセンのドグマが核内受容体リガンド結合領域立体構造で成立しており、レビンタールのパラドクスに一つの回答を提示した。
さらに、コファクター結合部位、ダイマー形成部位、ホモダイマー・ヘテロダイマー形成タイプの差異、特定アミノ酸残基のポイントミューテーションによってもたらされる立体構造変化などもすべて局所モチーフ理論で説明できることを示した。
核内受容体リガンド結合領域立体構造からアゴニストフォームとアンタゴニストフォームが実験的に確認されており、その主原因がリガンドとの立体反発の有無として解釈されているが、例外も多く、科学的な解明がなされていなかった。しかしながら、局所モチーフ理論に基づいて考察すると、既知リガンドは局所モチーフ構造の相互作用を増強あるいは弱体化する官能基もしくは置換基を有しており、増強する場合にはアゴニスト、弱体化する場合にはアンタゴニストになるとする考察で一貫して説明できることもわかった。すなわち、アゴニズムとアンタゴニズムという現象論に対して、より具体的に電子構造論的に解明し、これを核内受容体におけるアゴニズム・アンタゴニズム理論として提唱した。
さらに、本研究では一次構造上で遠隔位置にありかつ特定の共通位置にあるシグナルアミノ酸をアラインする方法を提案し、既存のマルチプルアランメントとは比較にならない精度の多重アミノ酸配列アラインメント法の可能性を示すことに成功した。