![]()
ホモロジーモデリング
ホモロジーモデリング プロトコールとアルゴリズム
各用語は詳細説明のページにリンクしています。
一般にホモロジーモデリング手法には確立した手順がなく、ホモロジーモデリングを実施する研究者が独自の手法を採用します。そのため、モデリングを実施した本人でさえも同じモデルを二度と作成できないという具合に、とても論理的といえるものではありません。一方、最近では手軽にホモロジーモデリングを経験できるツールが無償または有償で入手可能です。また、すでに予測されたモデルを公共機関から無償で参照できるようになっています。しかしながら、これらのツールや公開データから得られるモデルのほとんどは単に鋳型の座標をコピーしているだけかあるいは主鎖構造のみを考慮しているだけであり、そのままでは精密なシミュレーションを必要とする創薬研究などの研究には全く使い物になりません。これはアミノ酸一残基のコンフォメーションだけでも間違った配置にあるモデルでは、実際とは全く異なった基質結合部位形状を与えてしまうということを考えれば明らかです。少なくとも研究対象とするモデルの場合には、研究者はモデルの主鎖構造のみならず、側鎖やタンパク質分子に取り込まれているその他の分子や金属原子も含め、これらを精密に、そして科学的根拠に基づいて論理的にモデリングする必要があります。逆に、結晶構造が登録されるのを待っていれば、すでに研究し尽くされているか結晶化しない可能性が極めて高くなります。
真に利用価値のあるタンパクモデルはホモロジー検索を除いたホモロジーモデリングの各過程を以下に紹介する化学的根拠に基づいて論理的に実施してのみ得られます。なお、公共で提供される予測タンパクモデルや構造最適化機能のないモデリングソフトで作成したタンパクモデルは機能解析やシミュレーションに要求されるレベルのモデルとはとてもいえない状態のものと考えるべきです。
背景: あるアミノ酸配列が他の配列と20%以下の相同性しか示さない場合にも、対応するそれぞれの立体構造が共通のフォールドを採用しているケースがあります。
多くの場合、これらのアミノ酸配列を持つタンパクはファミリーを形成しています。
この過程では、標的アミノ酸配列に対するファミリーあるいは相同配列を探索します。また、その相同配列の立体構造が実験的に得られているか調査します。
ホモロジー検索の過程は、FASTAやBLASTなどの公共データベースを利用することで鋳型に適したシークエンスを容易に見つけることができます。また、外部に未知配列を投げたくない場合にも、これら公共データベースの解析プログラムおよびデータベースは一般に無料で入手できるため、in-houseで問題なく実施できます。
配列アラインメントはホモロジーモデリングで最も重要な過程です。すなわち、100%完全なアラインメントのみでしか有用なモデルを作成できません。
ここでは、予備的なアラインメントが、いくつかのスコアマトリックス(BlosumおよびPAM)を使用して、ペアワイズおよびマルチプルアラインメント解析によって得られます。
使用モジュールプログラム:Homology Modeling program
構造アラインメント(Structural Alignment)
構造アラインメントはファミリーの既知立体構造から抽出された二次構造部分に着目して配列をアラインします。
先の予備的なアラインメントはこの過程を通して精密化されます。
この過程では、標的配列に新たに加わった挿入部分あるいは欠損部分がループ上に現れるようにアラインします。しかしながら、こうして得られてきたアラインメントのたいていは不正確なままです。
使用モジュールプログラム:Homology Modeling program
この過程にある化学ロジックを追加することにより、非常に高精度なアラインメントを得ることができます。
本研究成果に関する論文が欧米査読誌に受理されています(Motonori Tsuji, J. Struct. Biol. 2014, 185, 355-365.)。
3Dモデリング(Three-Dimensional Modeling)
得られた最終アラインメントに基づいて既知立体構造を鋳型として標的配列の立体構造を予測モデリングします。
一般に、アミノ酸側鎖配座(ロータマー)は鋳型として用いたタンパクの側鎖ロータマーにあわせます(ロータマー最適化を参照)。
使用モジュールプログラム:Homology Modeling program
背景: アミノ酸配列の挿入あるいは欠損部分はループ上で多く観察されます。
また、共通のアミノ酸配列が異なるタンパク間で同様のループ構造を採用するケースがあります。
これらの観測事実から、多くのモデリングプログラムでは独自のループデータベースを搭載しています。
しかしながら、ループ生成ではインサーション残基数が5残基程度が限界となります。これは同じ配列の構造がデータベース中にないということのみならず同じ配列を一部にもっているタンパクがもはや存在しないからです。
残念ながら、生物界では2,30残基のインサーションは頻繁に起こります。
また、ループ構造がへリックスやシート構造と同様に高度に組織化された構造であることが徐々に認識され始めてきています。
さらに、挿入の場合には、対応する立体構造が更なる二次構造を形成していることがしばしば観測されます。
使用モジュールプログラム:Homology Modeling program
ロータマー最適化(Side-Chain Rotamer Modeling、Rotamer Optimizations)
背景: 疎水性アミノ酸残基はタンパク内部およびタンパク表面でほとんど異なるロータマーを採用しません。これは疎水性残基の関与する相互作用形態に関係しています。
背景: 極性および荷電アミノ酸残基はタンパク内部では同様にほとんど異なるロータマーを採用しませんが、タンパク表面ではロータマーは一定ではありません。
背景: 各アミノ酸側鎖がとりうるロータマーには統計的な傾向があります。
言い換えれば、側鎖ロータマーのモデリングは以上の化学的根拠に基づいて行われる必要があります。
特に、ドッキングスタディー等に用いるタンパクモデルではアラインメントの正確さのみならず、側鎖ロータマーの正確さが要求されます。これは一残基でもロータマーを間違えると、全く異なる基質結合部位形状を与えてしまうからです(ただし、実際には、良好な結果が得られること自体がまれである中で、アラインメントや側鎖ロータマーさらには全体構造のでたらめなモデルが、一見良好な結果を与えるということがしばしば起こります。つまり、既存の技術がその程度のものであるということを認識しておく必要があります)。
使用モジュールプログラム:Side Chain Rotamer Modeling program
構造最適化(Structural Optimizations)
すべての側鎖原子を分子力場計算(Amber)を用いて最適化します。
一般に、ヒスチジン、リジンおよびアルギニンはカチオンとして、アスパラギン酸およびグルタミン酸はアニオンとして取り扱います。また、NおよびC末端残基はツビッターイオンとして処理します。
鋳型タンパクに低分子等が含まれる場合、標的タンパクモデルの構造最適化は前もって処理されたこれらの低分子の存在下に実施することが望ましいと考えられます。これは少なからず、こうした分子からの立体的・電子的影響があるということと、モデル中に空間があると、これを埋めるように主鎖や側鎖が最適化されてしまうためです。また、このとき、ヘテロ原子上の水素原子は適切なアクセプターを考慮して最適化します。
得られたタンパク立体構造にひずみ等が見られる場合、束縛条件を用いた分子動力学計算が適用されます。
使用モジュールプログラム:Ramachandran Plot program
使用モジュールプログラム:Restraints program
使用モジュールプログラム:Peripheral Modeling program
インシリコ創薬戦略に戻る
2005年5月
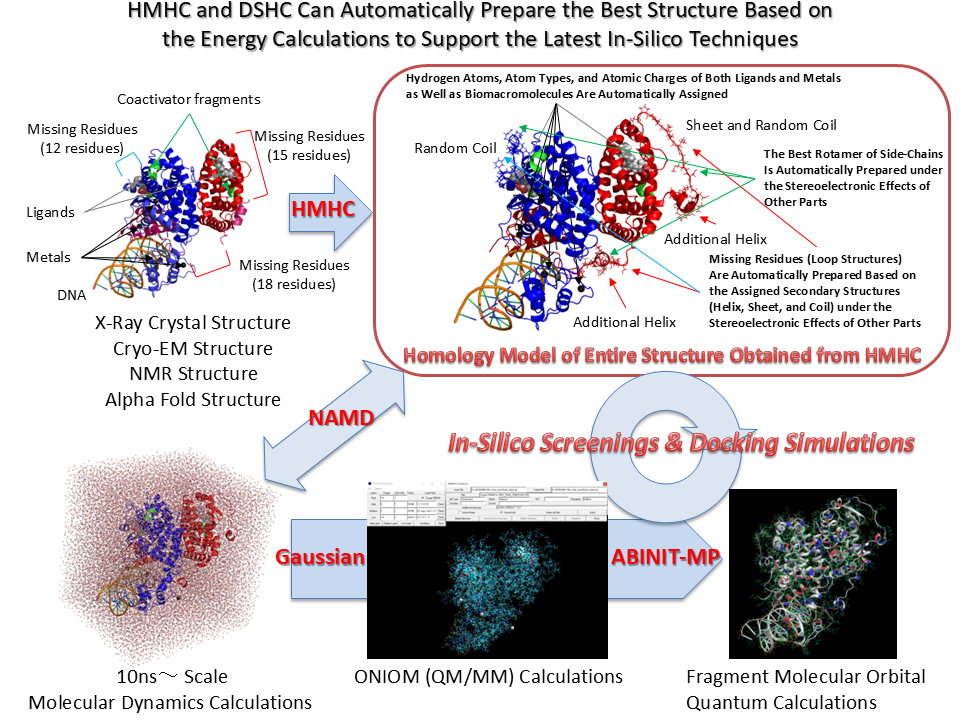
Homology Modeling Professional for HyperChemはホモロジーモデリングを論理的に実施し、機能解析やシミュレーションに利用できる高精度生体高分子システムモデルを作成するための全ての最新機能を搭載しています。
他の生体高分子との複雑な複合体構造を形成している鋳型を用いることで、これら分子からの立体・電子的影響下に標的配列のホモロジーモデリングが実施できるため、より精度の高いモデルを作成することができます。ホモロジーモデリングした標的分子は鋳型に含まれるその他の生体高分子や低分子を取り込んで、巨大生体高分子システムとしてモデリングできます。
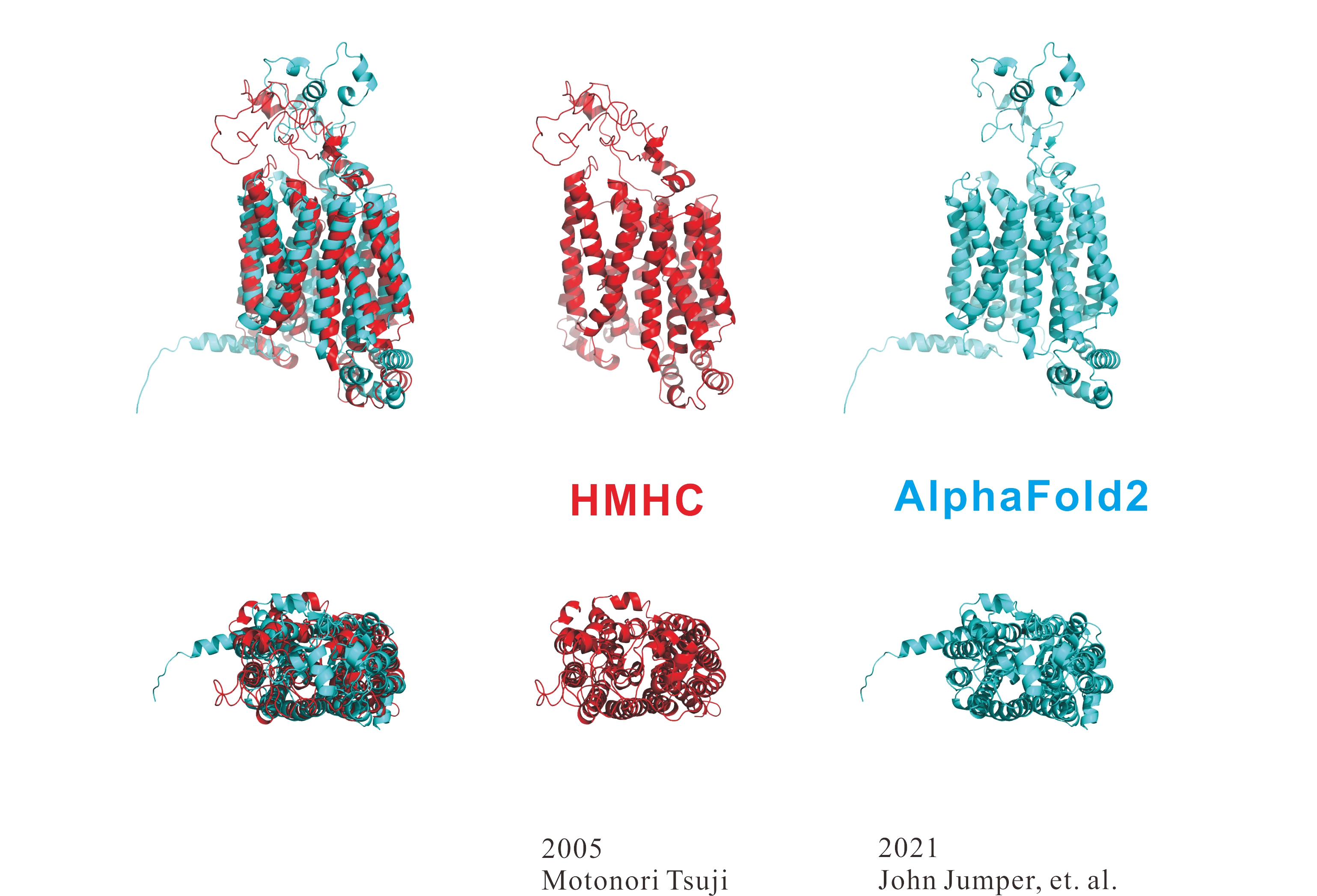
AlphaFold2 vs Homology Modeling Professional for HyperChem(HMHC)
下図は、アミノ酸配列が報告されてから20年以上もファミリーも含めて立体構造が不明なタンパク質についてHomology Modeling Professional for HyperChem(HMHC)とAlphaFold2で立体構造を予測した結果です。
HMHC(2005年公開)はAlphaFold2(2021年公開)より16年も前に公開していますが、膜貫通部分のアラインメントは一致しており、HMHCとAlphaFold2から得られたホモロジーモデルは熱力学的に複数のコンフォメーションを採用すると予測される膜外ループ構造が異なる程度でした。
本蛋白質は立体構造未知のため、どちらのホモロジーモデルが正解に近いかは現時点では不明ですが、HMHCはAlphaFold2と同様のモデルを提供できます。HMHCは側鎖ロータマーや生体高分子に含まれる結晶水や低分子までも高精度にモデリングできる点でアドバンテージがあります。加えて、HMHCではヘテロダイマーなどの高次構造や核酸との複合体モデルなども簡単にモデリングでき、量子化学計算プログラムGaussian(ONIOM計算)や分子動力学シミュレーションプログラムNAMDともシームレスに連携できます。AlphaFold2で主鎖構造を予測しておき、HMHCで側鎖立体配座や全体構造を精密化するといった方法論も有効と考えられます。
Homology Modeling Professional for HyperChem(HMHC)についてはこちら。
タンパク二次構造予測技術とab initio立体構造予測モデリング技術についてはこちら。
受託研究・共同研究
ホモロジーモデリングの受託研究・共同研究を受け付けています。20年以上の豊富な実績があります。お気軽にお問い合わせください。
| MFDDインシリコ創薬受託研究サービス 詳しくはこちら |